Ganze Bücher wurden schon über Brauwasser und dessen Aufbereitung geschrieben, selbst die Fülle an Informationen im Internet ist genauso groß wie unüberschaubar. Dazu zahlreiche Rechner, die Einheiten ineinander umwandeln, verschiedenste Hilfsstoffe und Aufbereitungsverfahren kennen, mit pH und mmol/l um sich schmeißen. So gewinnt man als Einsteiger schnell den Eindruck, dass Wasseraufbereitung viel Zeit bei wichtigeren Baustellen raubt.
Dabei muss Wasseraufbereitung nicht kompliziert sein, und kaum etwas anderes im Brauprozess wirkt sich so ausnahmslos positiv auf das Ergebnis aus. Dieser Artikel soll dabei helfen, das Thema Wasseraufbereitung selbstbewusst und ohne Rechnerunterstützung anzugehen.
Unsere Braumalze reagieren in salzfreiem Wasser sauer und verschieben den pH auf einen Wert zwischen circa 5,2 und 5,8. Nun ist unser Leitungswasser nicht salzfrei, sondern nimmt bei der Versickerung im Boden eine Vielzahl von Mineralien auf. Je nach Zusammensetzung dieser Mineralien kann das Wasser die saure Reaktion des Malzes verringern oder verstärken. Wir bezeichnen diese Eigenschaft unseres Brauwassers als dessen Restalkalität mit der Einheit °dH. Ist die Restalkalität ein positiver Wert, was in Deutschland so gut wie immer der Fall ist, dann erhöht sie den pH in der Maische. Ist sie negativ, kann sie ihn senken. Jeweils 10 °dH Restalkalität verschieben den pH um jeweils circa 0,3 Einheiten plus oder minus. Ist die Restalkalität genau 0 °dH, dann verhält sich das Brauwasser wieder wie völlig salzfreies Wasser.
Die saure Reaktion des Malzes ist gut, denn die meisten Prozesse beim Maischen und Würzekochen laufen bei einem pH von 5,4 am besten ab. Das liegt je nach Malz genau in dem Bereich, den wir durch salzfreies Wasser oder eben Wasser von 0 °dH Restalkalität schon automatisch treffen. Doch manchmal verstärkt das Malz die Reaktion unerwünscht stark in die eine oder in die andere Richtung, dann wird der Maische-pH zu hoch oder zu niedrig. Dem begegnen wir, schon bevor es mit dem Maischen losgeht, durch die Wasseraufbereitung.
Exkurs: Folgen eines günstigen Maische- und Würze-pH
- Verbesserte Enzymaktivität in der Maische, dadurch schnellere Verzuckerung, höhere Ausbeute und mehr Nährstoffe für die Hefe
- Deutlich geringere Zufärbung beim Kochen, weniger "Kochgeschmack" durch verminderte Maillard-Reaktionen. Essenziell für helle, schlanke Biere
- Geringere Auslaugung von Gerbstoffen aus den Spelzen und dem Hopfen, dadurch feinere Bittere
- Stärkerer Eiweißbruch
- Schafft die Grundlage für einen ausreichenden pH-Sturz bei der Gärung, der für Haltbarkeit und weichen Biergeschmack sorgt
Neben der Restalkalität interessiert uns im Brauwasser auch der Salzgehalt. An diesen stellen wir je nach Bierstil unterschiedliche Anforderungen. Betrachten wir exemplarisch zwei Wässer, die in ihrem Salzgehalt kaum unterschiedlicher sein könnten, aber eine ähnliche Restalkalität haben: Während das weiche, salzarme Pilsener Wasser in selbigem Bierstil für dessen legendären, weichen Charakter sorgen kann, nutzt man etwa das salzreiche Wasserprofil aus Burton-upon-Trent zur Unterstützung der Komplexität und des Hopfencharakters in einem English IPA.
Vertrauen ist gut, Kontrolle ist besser. Auch wenn wir uns der Materie Wasseraufbereitung systematisch nähern, sollte der Erfolg der vorgestellten Methoden immer mit einem pH-Meter kontrolliert werden. Die Wasserwerte unterliegen sehr oft saisonalen Schwankungen, etwa durch den bedarfsabhängigen Verschnitt von Wässern aus verschiedenen Pumpwerken. Zudem besitzen Maische und Würze komplexe Puffersysteme, weshalb eine Wasseraufbereitung immer nur eine Annäherung an die realen Verhältnisse sein kann. Mit ein wenig Routine werden Sie den pH-Meter aber wie die meisten anderen Messgeräte zunehmend seltener benötigen. Empfehlungen zur Erstausrüstung unter Abschnitt 6.
1. Wasseranalyse lesen
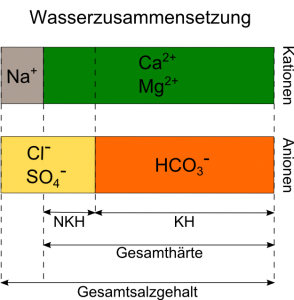
Die Gesamthärte eines Wassers beschreibt die Summe aller Ionen der Erdalkalimetalle. Für unsere Zwecke ist es ausreichend, hierunter die Summe der Calcium- und Magnesiumionen zu verstehen. Diese können wir weiter unterteilen in die Karbonathärte und die Nichtkarbonathärte. Unter Karbonathärte (KH) verstehen wir denjenigen Teil der Calcium- und Magnesiumionen (Ca2+, Mg2+), der an Hydrogencarbonat (HCO3-) gebunden ist. Der Rest ist die Nichtkarbonathärte (NKH), hier sind Calcium und Magnesium an andere Ionen gebunden, interessant beim Brauen sind hierunter vor allem Chloride (Cl-) und Sulfate (SO4-). Auch Natrium (Na+) kann in Verbindung mit Hydrogencarbonat oder anderen Ionen im Wasser vorkommen, wird aber nicht unter der Gesamthärte erfasst, zählt jedoch zum Gesamtsalzgehalt.
In Wasser gelöste Salze trennen sich in ihre Bestandteile, die Ionen, auf. Davon gibt es zwei, die negativ geladenen Anionen und die positiv geladenen Kationen. Sind sie erst einmal im Wasser gelöst, bewegen sich die Ionen frei umher. Das erlaubt uns, unser Rohwasser schematisch zu betrachten:
Anhand der Informationen aus Abb. 1 können wir die eingangs vorgestellte Restalkalität bereits präziser beschreiben. Die an Hydrogencarbonat (HCO3-) gebundene Karbonathärte reagiert alkalisch, vermindert also die saure Reaktion des Malzes und erhöht damit die Restalkalität. Calcium und Magnesium arbeiten dem entgegen, denn diese Ionen führen in der Maische zur Freisetzung von zusätzlicher Säure. Ist die saure Reaktion von Calcium und Magnesium stärker als die alkalische Reaktion des Hydrogencarbonats, wird die Restalkalität demnach geringer und sogar negativ. Genau das machen wir uns etwa bei der Gabe von Brausalzen wie Calciumsulfat (Braugips) zunutze.
Wie in Abb. 1 deutlich wird, zählt Natrium nicht zu unseren Definitionen von Wasserhärte, es fließt auch nicht in die Berechnung der Restalkalität ein. Dies muss uns vorerst aber nicht weiter stören.
Damit wir diese Verhältnisse im verwendeten Wasser bestimmen können, ist – klar – zunächst eine Wasseranalyse notwendig. Zur Auskunft mit jährlich aktuellen Werten sind die Wasserversorger bei unserem Trinkwasser generell verpflichtet, bei unzureichenden Informationen lohnt sich der direkte Kontakt, meist können umfangreiche Unterlagen zugeschickt werden. Die erfassten Parameter und verwendeten Einheiten fallen oft unterschiedlich aus. Die folgende Tabelle dient dazu, die vorhandenen Daten in geeignete Einheiten umzurechnen.
| Gesuchter Wert | Vorhandener Wert | Umrechnung |
|---|---|---|
| Calcium mg/l | Calcium mmol/l | Calcium mmol/l * 40,1 |
| Calciumhärte °dH | Calcium mmol/l | Calcium mmol/l * 5,6 |
| Calciumhärte °dH | Calcium mg/l | Calcium mg/l / 7,14 |
| Magnesium mg/l | Magnesium mmol/l | Magnesium mmol/l * 24,3 |
| Magnesiumhärte °dH | Magnesium mmol/l | Magnesium mmol/l * 5,6 |
| Magnesiumhärte °dH | Magnesium mg/l | Magnesium mg/l / 4,34 |
| Chlorid mg/l | Chlorid mmol/L | Chlorid mmol/l * 35,5 |
| Sulfat mg/l | Sulfat mmol/L | Sulfat mmol/l * 96,1 |
| Natrium mg/l | Natrium mmol/l | Natrium mmol/l * 23 |
| Hydrogencarbonat mg/l HCO3- mg/l | Hydrogencarbonat mmol/l | Hydrogencarbonat mmol/l * 61 |
| Hydrogencarbonat mg/l HCO3- mg/l | Alkalinität als CaCO3 (US) | Alkalinität / 0,82 |
| Karbonathärte °dh | Säurekapazität bis pH 4.3 mmol/l | Säurekapazität mmol/l * 2,8 |
| Karbonathärte °dh | HCO3− mmol/l = Hydrogencarbonat mmol/l | HCO3− mmol/l * 2,8 |
| Karbonathärte °dh | HCO3− mg/l = Hydrogencarbonat mg/l = Bicarbonat mg/l | (HCO3− [mg/l] / 61) * 2,8 |
| Nichtkarbonathärte °dH | Gesamthärte [°dH], Karbonathärte [°dH] | Gesamthärte [°dH] - Karbonathärte [°dH] |
| Restalkalität °dH | Säurekapazität mmol/l, Calcium mg/l, Magnesium mg/lL | Säurekapazität [mmol/l] * 2,8 - Calcium [mg/l] / 25 - Magnesium [mg/l] / 30 |
| Restalkalität °dH | Karbonathärte [°dh], Calciumhärte [°dH], Magnesiumhärte [°dH] | Karbonathärte [°dh] - Calciumhärte [°dH] / 3,5 - Magnesiumhärte [°dH] / 7 |
| Restalkalität °dH | Karbonathärte [°dh], Gesamthärte [°dh] (z.B. aus Wassertest bei eigenem Brunnen- oder Quellwasser) | Karbonathärte [°dh] - (Gesamthärte [°dh] / 4) (Faustformel, ungenau) |
2. Geeignetes Wasserprofil ermitteln
Die gerne zitierten 0 °dH Restalkalität sind zunächst einmal nur ein Bezugspunkt, mehr nicht. Für jeden Bierstil gelten unterschiedliche Anforderungen an die Restalkalität, was mit der Zusammensetzung der Malze, der stiltypischen Bitterkeit und zuletzt auch den Hefeeigenschaften zusammenhängt. Bierstile und ihre traditionellen Brauwässer spielen daher insofern eine Rolle, als Brauern früher nichts anderes übrig blieb, als ihre Rezepte so lange zu variieren, bis das Ergebnis stimmig war. Man braute dazu mit unterschiedlich dunklen Malzen, mit verschiedenen Hopfengaben und Stammwürzen, und mal wurde das Bier besser, mal schlechter. Dass es mit dem Wasser zusammenhing, wusste man vermutlich lange nicht, aber so haben sich über die Jahrhunderte Bierstile an ihre Brauwässer angepasst. Von einem geschätzten Redaktionskollegen wird bereits vehement die These vertreten, dass die Münchner nur deshalb Brauer von Weltruf wurden, weil sie sich mit ihrem fürchterlichen Brauwasser auseinandersetzen mussten.
Doch genug der Prosa! Unter Brauern hat sich eine Faustformel für helles Bier etabliert:
Ein günstiges Verhältnis von Karbonathärte zu Nichtkarbonathärte entsteht bei 1 : 2–2,5.
Berechnen Sie hierzu die Karbonathärte, und ziehen Sie diese von der ausgewiesenen Gesamthärte ab. Das Ergebnis ist die Nichtkarbonathärte. Diesen Wert teilen Sie durch 2 oder durch 2,5 für eine etwas intensivere Aufbereitung. Das Ergebnis ist eine für das jeweilige Brauwasser geeignete Karbonathärte, die von der säurefördernden Nichtkarbonathärte erfahrungsgemäß gut kompensiert wird. Andersherum können Sie natürlich auch die Karbonathärte mit 2 bis 2,5 multiplizieren und bekommen als Ergebnis die wünschenswerte Nichtkarbonathärte, die Sie mit Brausalzen auf Soll bringen.
Im Grunde können Sie mit diesem Tipp und den Tabellen unter Abschnitt 3 bereits das erste Pils oder Dortmunder Export brauen und erst bei Bedarf zu diesem Artikel zurückkehren. Für das Feintuning wird es sich jedoch lohnen, die historisch gewachsenen Besonderheiten der Bierstile kennenzulernen und auf einige Grenzwerte zu schauen, die nach allgemeiner Erfahrung nicht wesentlich überschritten werden sollten.
2.1. Allgemeine Grenzwerte
| Ion | Empfohlener Bereich zum Brauen | Grenzwert nach TwVO 2001* | Auswirkungen |
|---|---|---|---|
| Hydrogencarbonat | 0-500 mg/l | - | Die temporäre Härte, die als Kesselstein ausfallen kann. Stellt sich der Säure aus dem Malz entgegen und erhöht damit den pH der Maische. |
| Calcium | 50-150 mg/l | - | Senkt den pH der Maische und begünstigt dadurch enzymatische Vorgänge. Wichtiger Hefenährstoff und begünstigt die Klärung des Bieres. Werte wesentlich über 200 mg/L können einen mineralischen Beigeschmack haben, darunter gilt Calcium als geschmacksneutral. |
| Magnesium | 0-20 mg/l | - | Senkt den pH der Maische ebenfalls, aber nur halb so gut wie Calcium. Magnesium ist essentiell für die Hefe, aber da durch Malz per °Plato etwa 7mg/L eingebracht wird, sollte dieser Wert insbesondere bei hohen Stammwürzen klein gehalten werden. Die Folgen zu hoher Werte werden mit einer zunächst säuerlichen, dann zunehmend adstringierenden Wirkung beschrieben. In Stout und Porter kann der typische säuerlich-bissige Charakter der Röstmalze durch 30-40 mg/L Magnesium unterstützt werden. |
| Sulfat | 0-250 mg/l | 250 mg/l | Kann einen trockenen, hopfigen Trunk betonen. Vorsichtig bei hohen Magnesiumwerten, es entsteht Magnesiumsulfat (Bittersalz). Für einen spürbaren Effekt auf die Bitterwahrnehmung sind Werte von 200-250 mg/L anzustreben, der dabei entstehende Hopfencharakter wird vielfach als zupackender und nachhaltiger beschrieben. Dies kann für manche hopfenbetonten Biere vorteilhaft sein, aber etwa in hellen Lagerbieren süddeutscher oder böhmischer Brauart stören. |
| Chlorid | 0-150 mg/l | 250 mg/l | Das Anion, das Kochsalz "salzig" schmecken lässt. Werte von 50-100mg/l können die Vollmundigkeit heben. Werte ab 300 mg/l können in Verbindung mit Natrium und Kalium für einen unangenehm salzigen Beigeschmack führen, der wiederum dem Empfinden der Vollmundigkeit abträglich ist. |
| Natrium | 0-50 mg/l | - | Kann bis 100 mg/l die Vollmundigkeit betonen. Vorsicht jedoch bei hohen Chloridwerten, zusammen mit den hohen Kaliumwerten aus Malz ergibt sich schnell ein salziger Beigeschmack. Der Wert sollte im Zweifelsfall klein gehalten werden. |
| Nitrat | < 40 mg/l | 50 mg/l | Kann durch Mikroorganismen während der Gärung zu Nitrit reduziert werden, siehe dort. Überprüfung insbesondere bei Brunnenwasser sinnvoll. Bei Gärproblemen testweiser Verschnitt mit vollentsalztem Wasser anzuraten. |
| Nitrit | < 3 mg/l | 0,5 mg/l | Wirkt stark hemmend auf die Hefe. Wird daher etwa in Pökelsalz zur Konservierung eingesetzt. |
| Eisen | < 0,1 mg/l | 0,2 mg/l | Führt zu Fehlaromen und verstärkter Oxidation. Eintrag etwa auch durch Rost im Leitungswasser oder beschädigte Emaille u.ä. |
| Kupfer | < 1mg/l | 2 mg/l | Hefenährstoff, aber katalysiert wie Eisen die Oxidation des Bieres. |
2.2. Zielwerte nach Bierstil
Beginnen wir thematisch im wahrsten Sinne bei null, nämlich einer Würze aus destilliertem Wasser, so stellt sich die Zusammensetzung einer Würze mit 10 °P wie folgt dar:
Natrium: 10 mg/l
Calcium: 35 mg/l
Magnesium: 70 mg/l
Chlorid: 125 mg/l
Sulfat: 5 mg/l
(Quelle: Water, S. 178[1])
Wir wissen daher, dass – ganz egal, wie unser Rohwasser zusammengesetzt ist – schon alleine abhängig von der Stammwürze eine bestimmte Menge an Mineralien eingetragen wird. Mit den Grenzwerten aus 2.1. im Hinterkopf wird klar, dass wir etwa bei einem IPA mit 18 °P aufpassen müssen, was wir dem Wasser noch hinzufügen dürfen. Auch gibt es unabhängig von oberen Grenzwerten Bierstile, für die salzarmes Wasser typisch ist. Ebenso haben wir gelernt, dass die Restalkalität eine Rolle beim Maische-pH spielt. Hier kommt ein weiterer Faktor ins Spiel, nämlich dass dunkles Malz saurer reagiert als helles Malz. Besonders sauer reagieren Caramalze. Eine weitere Stellschraube ist die Bitterkeit. In Gegenden mit hoher Restalkalität wurde traditionell mild gebittert, populäres Beispiel sind die im Münchener Raum verbreiteten Bierstile Münchner Helles, Münchner Dunkel und Weißbier. Andersherum wurden aus Wässern mit geringer Restalkalität wie Pilsener Wasser und dem beinahe legendär calciumsulfatreichen Wasser von Burton-upon-Trent gerne Biere mit hoher Bitterkeit gebraut.
Wir kommen damit in grober Annäherung zu folgenden Regelmäßigkeiten:
- Bierstil und steigende Stammwürze limitieren den Salzgehalt des Rohwassers und den zusätzlichen Einsatz von Brausalzen.
- Die Menge dunkler Malze eines Bieres, insbesondere der dunklen Caramalze, bestimmt, wie viel Restalkalität ohne unser Zutun neutralisiert wird.
- Wässer niedriger Restalkalität erlauben kräftig gehopfte Biere, Wässer hoher Restalkalität nur mild gehopfte Biere.
Unter diesen Aspekten gelangen wir zu folgender Tabelle einiger beliebter Bierstile:
| Bierstil | Bitterkeit | Restalkalität °dH | Calcium mg/l | Magnesium mg/l | Aufbereitung | Sulfat mg/l | Chlorid mg/l |
|---|---|---|---|---|---|---|---|
| Helles Lagerbier, Münchner Helles, American Lager | ausgewogen | -3-0 °dH | 30-50 | 0-20 | Entkarbonisierung, Maischesäuerung auf pH 5,4 | 0-50 | 50-100 |
| Böhmisches Pilsener | herb | -2-0°dH | 0-30 | 0-20 | Vollentsalzung, Maischesäuerung auf pH 5,4 | 0-50 | 0-50 |
| Deutsches Pils, Premium Lager | herb | -5-0 °dH | 50-75 | 0-20 | Entkarbonisierung, ggf. Aufsalzen, Maischesäuerung | 50-150 | 50-100 |
| Dortmunder Export | herb | 0-2 °dH | 75-100 | 0-20 | Entkarbonisierung, ggf. Aufsalzen | 100-200 | 50-100 |
| Märzen, Festbier | ausgewogen | 0-5°dH | 50-75 | 0-25 | Entkarbonisierung, optionale Maischesäuerung | 0-100 | 50-150 |
| Dunkles Lagerbier, Münchner Dunkel, Schwarzbier, Fränkisch Dunkel | ausgewogen | 3-6 °dH | 50-75 | 0-25 | ggf. Entkarbonisierung, Aufsalzen mit Calciumchlorid | 0-50 | 50-150 |
| Helles Bockbier, Maibock, Doppelbock | ausgewogen bis herb | 5-10 °dH | 50-75 | 0-20 | ggf. Maischesäuerung | 0-100 | 50-150 |
| Dunkles Bockbier | ausgewogen | 10 °dH | 50-100 | 0-25 | ggf. Maischesäuerung | 0-100 | 50-100 |
| Helles Ale, Ordinary Bitter | mild bis ausgewogen | -5-0 °dH | 50-100 | 0-25 | Entkarbonisierung, Maischesäuerung auf pH 5,4 | 100-200 | 50-100 |
| Mild Ale, Best Bitter, Scotch Ale | ausgewogen | 0-5 °dH | 50-150 | 0-25 | Entkarbonisierung | 100-200 | 50-100 |
| Irish Dry Stout, Porter | ausgewogen bis herb | 2-7 °dH | 50-75 | 15-35 | ggf. Entkarbonisierung, Sulfat und Chlorid in Balance halten, wenig Magnesiumsulfat stützt den "sour tang" | 50-150 | 50-100 |
| Weizenbier, Weizenbock | mild | 5-10 °dH | 50-100 | 0-20 | ggf. Entkarbonisierung, im Interesse von Estern keine Maischesäuerung | 0-50 | 50-100 |
| Wit, Cream Ale, Kölsch | ausgewogen bis herb | -3-0 °dH | 50-100 | 0-25 | Entkarbonisierung, Maischesäuerung auf pH 5,4 | 0-50 | 0-100 |
| American Pale Ale, American IPA | herb | -3-0 °dH | 50-150 | 0-20 | ggf. Vollentsalzung bei hohen Nitratwerten (Eintrag durch Hopfen!), sonst Entkarbonsierung, Aufsalzen mit Calciumsulfat, optionale Maischesäuerung | 100-400 | 0-100 |
| Altbier, Extra Special Bitter (ESB), English IPA | ausgewogen bis herb | 0-5 °dH | 50-150 | 0-25 | Ggf. Entkarbonisierung, wenn Gabe von Calciumsulfat nicht ausreichend | 100-300 | 50-100 |
| Extra Stout, Sweet Stout, Oatmeal Stout | ausgewogen bis herb | 5-10 °dH | 50-75 | 15-35 | Wenig Magnesiumsulfat stützt den "sour tang", ggf. Maischesäuerung | 50-150 | 50-150 |
| Belgische Ales, Tripel, Blonde | ausgewogen | 0 °dH | 50-100 | 0-20 | Entkarbonisierung, optionale Maischesäuerung auf pH 5,4 | 50-100 | 50-100 |
| Brown Ale, Strong Scotch Ale, Barleywine | ausgewogen bis herb | 0-5 °dH | 50-100 | 0-20 | Entkarbonisierung | 50-100 | 50-150 |
| Russian Imperial Stout | ausgewogen bis herb | 8-15 °dH | 50-75 | 0-25 | ggf. Maischesäuerung | 50-150 | 50-150 |
2.3. Rechnerischer Ansatz
Es existieren rechnerische Ansätze, die über die Wasserzusammensetzung und die eingesetzten Malze eine Vorhersage über den Maische-pH treffen und Berechnungen über Brausalze und Säuren anstellen, mit denen man zum Ziel-pH gelangt. Die Umsetzungen[2] unterscheiden sich bei identischen Eingaben teilweise erheblich in der Vorhersage. Das erstaunt bei genauerer Betrachtung wenig, sind doch schon die Rohdaten über den Säurebeitrag der Malze in Abhängigkeit von der Wasserzusammensetzung sehr inhomogen. Auf dem Gebiet ist sicher noch einiges zu tun, bevor man den pH-Meter in die Schublade legen kann.
2.4. Evergreen Chlorid-Sulfat-Verhältnis
Es wäre an dieser Stelle sicher am einfachsten, auf die seit Jahrzehnten kursierende Empfehlung zu verweisen, dass Sulfat und Chlorid in einem bestimmten Verhältnis zueinander stehen sollten: sulfatlastig bis zu 4:1 für einen betonten Hopfencharakter, chloridlastig bis zu 1:2 für einen milden, malzbetonten Charakter, und ein Verhältnis von 1:1 für einen ausgewogenen Charakter. Während die geschmacklichen Beschreibungen von Sulfat und Chlorid (siehe Tabelle 1) in Praxis und Theorie immer wieder bestätigt werden, tut man sich mit der Literaturrecherche zu einem relativen Zusammenhang zwischen diesen Ionen eher schwer. Die Annahme, ein Wasserprofil könne nicht nur über die absolute Ionenkonzentration, sondern auch durch deren Verhältnis zueinander jeweils hopfenlastige oder malzige Biere erzeugen, setzt voraus, dass ein bisher unbekannter Mechanismus die messbaren Verhältnisse überlagert. Während dies nicht auszuschließen ist, konnte ich eine Beschreibung eines derartigen Mechanismus in der einschlägigen Literatur nicht finden.
Bei genauerer Betrachtung werden auch methodische Ungereimtheiten offensichtlich. Schaut man sich etwa die Werte aus Abschnitt 2.2 genauer an, wird klar, dass selbst ein sorgsam eingestelltes Chlorid-Sulfat-Verhältnis im Rohwasser spätestens durch die Malzzugabe stark zugunsten des Chlorids verschoben wird. Dies wirft Fragen auf: Ist nun von der Summe der Chlorid- und Sulfationen im fertigen Bier auszugehen oder im Rohwasser? Warum wird der stammwürzebedingte Eintrag von Chlorid und Sulfat nicht berücksichtigt? Ferner: Wie kann sich ein vermeintlich hopfenlastiges Ionenverhältnis im zweistelligen Bereich (beispielsweise 10 mg/l Chlorid zu 40 mg/l Sulfat) auswirken, wenn im Anschluss >125 mg/l Chlorid durch das Malz eingebracht werden?
Wie man es dreht und wendet, das Chlorid-Sulfat-Verhältnis ergibt derzeit kein schlüssiges Bild. Erfolge in der Praxis lassen sich auch darauf zurückführen, dass bei der Zielsetzung eines "malzigen" oder "hopfenlastigen" Bieres auch an anderen Stellschrauben wie der Hopfenmenge, Caramalzen und Vergärungsgraden gedreht wird. Meine Empfehlung lautet daher: Mit Chlorid und Sulfat unterhalb der etablierten Werte bleiben und bei hohen Stammwürzen mit Chlorid zurückhaltend sein. Das Verhältnis ignorieren.
3. Aufbereitungsverfahren
In diesem Abschnitt werden gängige Aufbereitungsverfahren mit ihren Besonderheiten vorgestellt. Eine Wasseraufbereitung ist genau dann geeignet, wenn sie alle Wasserwerte des Rohwassers in den gewünschten Zielbereich bringt. Dieser Zielbereich ist zum Teil stilabhängig, aber zum Teil gibt es auch einen Konsens über bestimmte Grenzwerte (siehe Abschnitt 2.1.), die nicht wesentlich überschritten werden sollten. Als Orientierungshilfe soll nachfolgende Tabelle dienen:
| Parameter | Aufbereitung |
|---|---|
| Nitrat > 30 mg/L Sulfat > 250 mg/L Chlorid > 150 mg/L Natrium > 100 mg/L | Vollentsalzung durch Ionentauscher oder Umkehrosmose; Verschnitt mit vollentsalztem Wasser |
| Nitrat, Sulfat, Chlorid, Natrium: ok Magnesium > 30 mg/L | Kalkwassermethode mit Split-Treatment, Schwach saurer Kationentauscher. |
| Nitrat, Sulfat, Chlorid, Natrium, Magnesium: ok Hydrogencarbonat > 350 mg/L Sulfat > 150 mg/L Chlorid > 100 mg/L | Entkarbonisierung durch Kochen, einstufige Kalkwassermethode, Milchsäure, Sauermalz, biologische Säuerung |
| Obige Werte: ok | Mineralsäuren, Aufhärtung |
3.1. Aufhärten/Aufsalzen
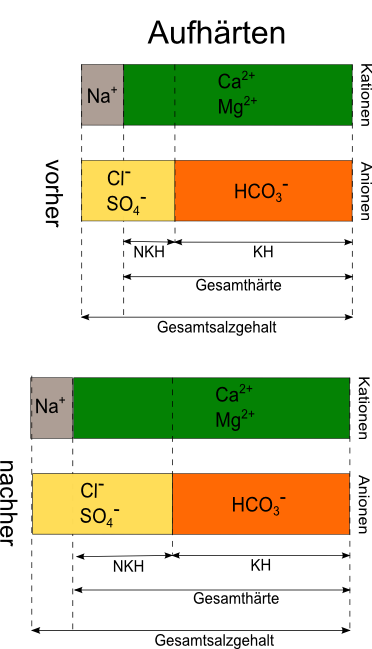
Calciumchlorid und Calciumsulfat reagieren in der Maische sauer und senken hierdurch den pH. Innerhalb der Grenzwerte eingesetzt, ist dies eine recht natürliche Form der Aufbereitung, da diese Salze auch im Brauwasser und den Malzen vorkommen. Die Zugabe von Calcium- und Magnesiumsalzen bezeichnet man auch als Aufhärten, denn wir erhöhen die säurefördernde Nichtkarbonathärte, ohne an der säurevernichtenden Karbonathärte etwas zu ändern; so sinkt deren Einfluss.
Anmerkung zu den verwendeten Additiven
- Wir hantieren unter anderem mit starken Säuren und starken Laugen (etwa Calciumhydroxid). Die übliche Vorsicht im Umgang mit diesen Stoffen ist geboten, Sicherheitshinweise beachten.
- Zertifizierung nach Ph. Eur., Dt. Arzneimittelbuch oder Lebensmittelqualität mit E-Nummer ist obligatorisch! Technische Mineralsäuren und Salze sind mit Schwermetallen verunreinigt.
- Lagerung immer dicht verschlossen und am besten nicht in der Sudküche (Luftfeuchtigkeit).
| Verbindung | Benötigte Menge für - 1°dH Restalkalität | Maische pH | Änderung Kationen pro 1g | Änderung Anionen pro 1g |
|---|---|---|---|---|
| Calciumsulfat-Dihydrat | 107,4 mg/l | senkend | +232,78 mg Calcium | +557,93 mg Sulfat |
| Calciumchlorid-Dihydrat | 91,7 mg/l | senkend | +272,60 mg Calcium | +482,28 mg Chlorid |
| Magnesiumchlorid-Hexahydrat | 251 mg/l | schwach senkend | +119,53 mg Magnesium | +174,39 mg Chlorid |
| Magnesiumsulfat-Heptahydrat | 307,7 mg/l | schwach senkend | +98,59 mg Magnesium | +389,73 mg Sulfat |
| Natriumchlorid | keine Änderung | neutral | +393,39 mg Natrium | +606,66 mg Chlorid |
| Natriumhydrogencarbonat | 30 mg/l (+1°dH) | stark erhöhend | +273,66 mg Natrium | +726,34 mg Hydrogencarbonat |
Zur Erhöhung des Maische-pH, etwa für sehr dunkle Biere aus weichem Wasser, wird verschiedentlich auch die Gabe von CaCo3 (Kalk) diskutiert. Jedoch scheint sich Calciumcarbonat sogar in der sauren Maische nur schlecht zu lösen[3], wodurch die Gaben kaum kalkulierbar werden. Insbesondere ohne eine pH-Kontrolle der Maische ist zur Erhöhung des Maische-pH daher die Gabe des gut und schnell löslichen Natriumhydrogencarbonats das Mittel der Wahl.
Vorteile
- Kommt in Brauwasser ohnehin vor, Nachbau historischer Brauwässer
- Wertvolles Calcium durch Calciumchlorid und Calciumsulfat
- Günstig, schnell
Nachteile
- Meist Feinwaage nötig
- Senkung der Restalkalität nur bei gleichzeitiger Erhöhung der Nichtkarbonathärte
- Mögliche Geschmacksbeeinträchtigung
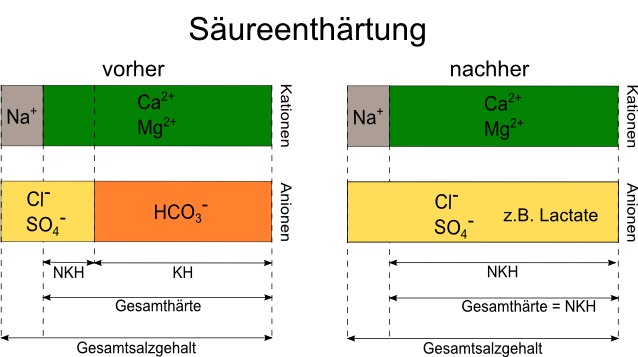
3.2. Säureenthärtung
Starke Säuren verdrängen das Hydrogencarbonat, dieses wandelt sich zu Wasser und CO2 um. Dabei entstehen die Calcium- und Magnesiumsalze der zudosierten Säure. Wir erhöhen daher bei gleichbleibender Gesamthärte die Nichtkarbonathärte. Wir müssen also beachten, dass eine Säuregabe unser Wasser um den Betrag des vernichteten Hydrogencarbonats "salziger" macht. Die in Deutschland gebräuchlichste Säure ist Milchsäure, im gewerblichen Bereich zugelassen in der Form von Sauermalz und biologischer Säuerung. Die Milchsäure entsteht dabei durch malzeigene Milchsäurebakterien.
Die hier besprochene Säureenthärtung ist nicht mit der Maische- und Würzesäuerung zu verwechseln. Da das Malz zum Zeitpunkt dieser Säuregaben seine Pufferwirkung bereits entfaltet hat, stellen sich andere Verhältnisse ein, und es werden andere Berechnungen notwendig. Dies wird Teil eines gesonderten Artikels in einer der kommenden Ausgaben.
Abseits des Reinheitsgebots bietet sich eine breitere Auswahl an Säuren an. So kann man sich etwa Schwefelsäure und Salzsäure zunutze machen, um statt der Lactate durch Milchsäure zusätzliche Chloride und Sulfate einzubringen. Oder Phosphorsäure, um bei Rohfruchtsuden die Ausstattung mit dem Hefenährstoff Phosphat zu verbessern. Die Säuregaben in nachfolgender Tabelle wurden zwecks besserer Lesbarkeit pro Hektoliter Brauwasser angegeben. Bis auf Milchsäure wurde die Einsatzmenge auf 10-%ige Konzentrationen bezogen, da der Umgang damit ungefährlicher und leichter in der Dosierung wird.
| Säure | Gabe für -1 °dH Restalkalität pro hl Brauwasser | Zusätzliche Salze pro -1 °dH | Geschmack |
|---|---|---|---|
| Milchsäure 80% | 3,32 ml (4,0 g) | + 32 mg/l Lactat | 400 mg/l gelten als Geschmacksschwellenwert hin zu einer milchsauren Note. Dies alleine würde eine Enthärtung um bis zu 12°dH Restalkalität erlauben. Da in der Gärung jedoch je nach Hefe zwischen 50-300 mg/l Milchsäure entstehen können, sollte der Wert konservativer angesetzt werden. |
| Salzsäure 10% | 12,4 ml (13,0 g) | +13 mg/l Chlorid | Siehe Chlorid im Brauwasser, Tabelle 1. |
| Schwefelsäure 10% | 16,4 ml (17,5 g) | +17 mg/l Sulfat | Siehe Sulfat im Brauwasser, Tabelle 1. |
| Phosphorsäure 10% | 33,2 ml (35,0 g) | +34 mg/l Phosphat | Gilt geschmacklich als unauffällig und dient der Hefe als Nährstoff, daher interessant etwa bei Rohfruchtsuden. Phosphate fällen jedoch das wichtige Calcium, das dann im späteren Prozess nicht mehr zur Verfügung steht. So kann etwa der pH Sturz bei der Gärung unzureichend ausfallen. Daher nur begrenzt und bei hohen Calciumreserven (>100 mg/l) empfehlenswert. |
Seltener verwendet werden Zitronensäure und Essigsäure, die beide einen unangenehmen Geschmacksbeitrag leisten und daher nicht besprochen wurden.
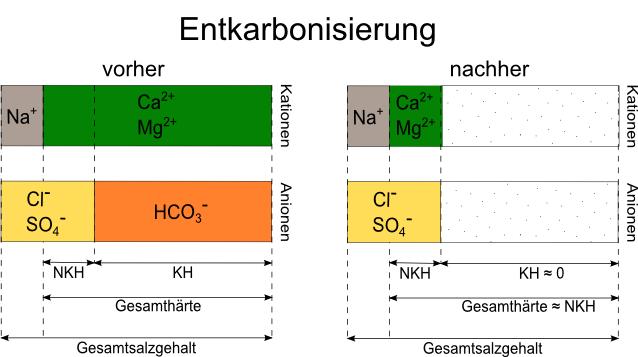
3.3. Entkarbonisiserung
Gelöstes CO2 im Wasser macht Kalk überhaupt erst löslich. Möchten wir diesen Kalk wieder unlöslich machen und infolge dessen als Kesselstein ausfällen, muss das CO2 wieder raus. Daher der Begriff der "Ent-karbonisierung". Hierzu gibt es drei hobbytaugliche Möglichkeiten. Allen gemeinsam ist, dass die Nichtkarbonathärte unverändert bleibt. Im Gegensatz zur Aufbereitung mit Salzen oder Säuren fügen wir also nichts hinzu, sondern nehmen nur heraus. Ist die Nichtkarbonathärte aber bereits im Ausgangswasser nicht für einen Bierstil geeignet, was recht selten der Fall ist, dann wäre eine reine Entkarbonisierung nicht zielführend. In diesem Fall helfen die Verfahren unter 4.3.
3.3.1. Kochen
Durch mindestens halbstündiges wallendes Kochen der Gesamtwassermenge wird CO2 ausgetrieben, es bleibt unlösliches Calciumcarbonat als Kesselstein übrig. Nach Abstehen über Nacht wird der klare Überstand abgezogen. Die an Magnesium gebundene Härte kann zwar ausgefällt werden, Magnesium selbst ist auf diese Weise aber nicht entfernbar. Es verbleibt in der Praxis meist eine Karbonathärte von 2 °dH. Selten erwähnt, aber wichtig: Bei der Reaktion wird Calcium "verbraucht". Sie funktioniert daher nur, wenn genügend Calcium vorhanden ist. Um 3 mg Hydrogencarbonat zu fällen, benötigt man circa 1 mg Calcium. Rechenbeispiel: Bei 300 mg/l HCO3- (entspricht ~13,8 °dH Karbonathärte) sollte man >100 mg/l Calcium im Brauwasser haben, sonst ist die Ausfällung von Calciumcarbonat unvollständig.
Da im fertigen Brauwasser ohnehin Calciumwerte von >50 mg/l empfohlen sind, sollte ein geplantes Aufsalzen mit Calciumchlorid oder Calciumsulfat vor dem Kochen erfolgen.
Vorteile
- Equipment vorhanden
- Gelingsichere, reproduzierbare Methode
Nachteile
- Energieintensiv
- Magnesium nicht entfernbar
3.3.2. Kalkwassermethode
Durch die Zugabe von Calciumhydroxid steigt der pH-Wert des Wassers, und das Kalk-Kohlensäure-Gleichgewicht verschiebt sich hin zu Kalk, der ausfällt. Durch das Split-Treatment-Verfahren ist auch Magnesium als Magnesiumhydroxid ausfällbar. Im Artikel Irgendwie seltsam dieser Ausgabe wird das Vorgehen ausführlich beschrieben.
Vorteile
- Günstig
- Magnesium ausfällbar
Nachteile
- Zeitintensiv
- Gefahr der Überkalkung
- Calciumhydroxid muss unter Luftabschluss gelagert werden
3.3.3. Schwach saurer Kationentauscher
Schwach saures Kationentauscherharz tauscht die an Hydrogencarbonat gebundenen Calcium- und Magnesiumionen gegen H+-Ionen aus. Aus dem Hydrogencarbonat entstehen dadurch Wasser und Kohlensäure, die wir als CO2 austreiben können. Das Wasser muss daher belüftet werden, bis der pH-Wert nahe 7 ist.
Vorteile
- Schnell (1 l Harz entkarbonisiert circa 60 l/h)
- Vollständige Entfernung von Magnesium
Nachteile
- Gelegentliche Regeneration mit Salzsäure 5 % (circa 2 l für 1 l Harz) notwendig
- Wasser nach Behandlung sauer und korrosiv, muss belüftet werden
3.4. Vollentsalzung
Während bei den bisher vorgestellten Methoden nur der Einfluss der Karbonathärte gedämpft wurde, wurde die Nichtkarbonathärte jeweils belassen oder sogar erhöht. Ist ein besonders salzarmes Brauwasser etwa für helle Lagerbiere gefordert oder soll ein Brauwasser von Grund auf neu aufgebaut werden, so wird zunächst eine Vollentsalzung notwendig. Zur Darstellung des wünschenwerten Calciumgehalts von >50 mg/l können nach Vollentsalzung je 1 g Calciumsulfat und 1 g Calciumchlorid gegeben werden für eine Restalkalität von –2°dH. Für höhere Restalkalitäten bietet sich der Verschnitt mit Rohwasser an.
3.4.1. Kationen- und Anionentauscherharze, Mischbettharze
Durch die Kombination eines stark sauren Kationentauscherharzes, gefolgt von einem schwach basischen Anionentauscherharz, werden alle Ionen des Wassers bis auf CO2 und SiO2 entfernt. Das Wasser ist dann salzfrei. CO2 und SiO2 sind für Brauzwecke unproblematisch, das CO2 wird spätestens beim Erwärmen ausgetrieben. Entfernen ließen sie sich nur mit einem stark basischen Anionentauscherharz, das jedoch durch die Bindung des CO2 eine geringere Literleistung als die schwach basische Variante aufweist.
Während Kationen- und Anionentauscherharze in jeweils getrennten Säulen regenerierbar sind, ist ein vorbereitetes Mischbettharz kaum selbst zu regenerieren, sondern wird in der Regel im Austausch an den Händler zurückgegeben.
Vorteile
- Schnell
- Vollständige Beseitigung aller unerwünschten Ionen
- Entfernung auch von Nitrat und Schwermetallen
- Möglichkeit, ein Brauwasser von null an aufzubauen
Nachteile
- Regeneration mit Salzsäure und Natronlauge nötig
- Hohe Anschaffungskosten
- Möglichkeit des Verkeimens bei längeren Standzeiten
Kosten: ab etwa 80 Euro
3.4.1. Umkehrosmose
Durch eine semipermeable Membran gelangt im Idealfall nur Wasser. Die zurückgehaltenen Bestandteile werden mit Leitungswasser von der Membran gewaschen. Hierdurch entstehen auf einen Teil Reinwasser je nach System etwa zwei bis fünf Teile Abwasser.
Vorteile
- Vollständige Beseitigung aller unerwünschten Ionen
- Entfernung auch von Nitrat und Schwermetallen
- Entfernung auch von organischen Verunreinigungen; deren Summe wird im Wasserbericht als TOC [mg/l] ausgewiesen
- Möglichkeit, ein Brauwasser von null an aufzubauen
- Keine Regeneration notwendig, dadurch immer einsatzbereit
Nachteile
- Vorfilter neigen bei seltener Benutzung zur Verkeimung
- Daher regelmäßiger Filtertausch notwendig
- Abwasser
- Meist geringe Stundenleistung
Kosten: ab etwa 60 Euro
3.4.2. Verschnitt mit vollentsalztem Wasser
Keine Aufbereitung im eigentlichen Sinne, aber eine gute Methode, um herauszufinden, ob sich positive Veränderungen am Geschmack abzeichnen, ohne gleich in Ionentauscher oder eine Osmoseanlage investieren zu müssen. Auch wenn der Bedarf eher gering ist, kann sich der Zukauf gegenüber den laufenden Kosten etwa durch Verschleiß und Verkeimung lohnen. Die Wasserwerte lassen sich alle linear verdünnen, hier ist also die einfache Berechnung nach Dreisatz möglich.
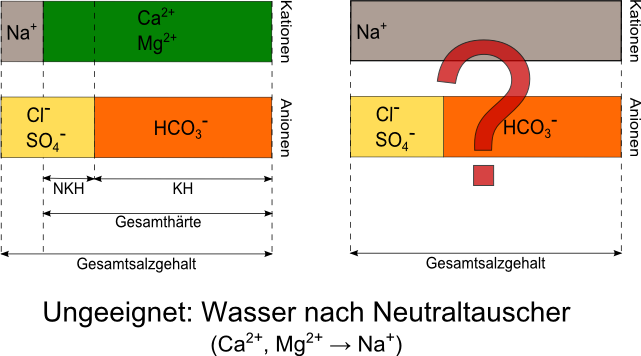
3.6. Neutraltauscher
Ein häufig in Haushalten anzutreffender Ionentauscher-Typ ist der mit Kochsalz regenerierbare Neutraltauscher. Hierbei werden die Härtebildner Calcium und Magnesium an einem stark sauren Kationentauscherharz vollständig durch Natriumionen ersetzt. Das dabei entstehende Natriumhydrogencarbonat ist gut löslich und kann daher nicht als Kesselstein ausfallen. Dies schützt Geräte vor Verkalkung. Für Brauzwecke ist es jedoch völlig ungeeignet. Es ist zum einen nichts gegen die säurevernichtende Wirkung des Hydrogencarbonats unternommen, und zum anderen fehlt die saure Reaktion des entfernten Calciums und Magnesiums im Wasser. Ist kein anderes Wasser verfügbar, also auch keine Möglichkeit vorhanden, das Wasser vor dem Ionentauscher zu entnehmen, so empfehle ich den Kauf von vollentsalztem Wasser beziehungsweise dessen Erzeugung.
4. Ausrüstung
4.1. pH-Messung
Die Messung mit pH-Messstreifen und -stäbchen ist aufgrund der komplexen Zusammensetzung der Maische nach allgemeiner Überzeugung einem zu großen Fehler unterworfen und somit bestenfalls eine Übergangslösung.
Digitales Messgerät
- Auflösung 0,1 pH mit Fehler +/–0,1 pH ist ausreichend.
- Zwei-Punkt-Kalibrierung vorteilhaft, kaufen Sie nur Geräte mit Kalibriermöglichkeit und -lösung.
- Die Messelektrode ist ein Verbrauchsmaterial, weshalb sie in höheren Preisklassen austauschbar ist. Jedoch kosten Ersatzelektroden dieser Geräte oft mehr als Einsteigergeräte.
- Überprüfung der Kalibrierung am besten vor jedem Brautag, die pH-Skala ist logarithmisch, hier machen Nachkommastellen viel aus. So ist etwa pH 5,4 doppelt so sauer wie pH 5,7.
- Automatische Temperaturkorrektur (ATC) vorteilhaft
- Einstiegsklasse: "Mudder" (diverse Ausführungen, circa 20 Euro), Conrad Voltcraft PHT-02 (circa 60 Euro, Elektrode wechselbar)
- Semiprofessionelle Klasse: Greisinger GPH 114 (circa 100 Euro, Ersatzelektrode 60 Euro), Hanna Super pHep 4 (circa 100 Euro, automatische Kalibrierung, Ersatzelektrode 60 Euro), Extech ExStik PH100 (circa 110 Euro, Ersatzelektrode 30 Euro)
4.2. Brausalze und Säuren
Mit Calciumchlorid und Calciumsulfat sind 99 Prozent der Anwendungsfälle gedeckt und erlauben bei der Wasseraufbereitung alle Freiheiten. Bezug der Calciumsalze über die gängigen Braushops, Apotheke (ab 250 g oft deutlich günstiger) oder Feinchemikalien-Versandhandel. Auf Reinheit nach Ph. Eur. oder Lebensmittelqualität (E-Nummer) achten.
Kochsalz (ohne Jod und Fluorid) und Natriumhydrogencarbonat (Natron; kein Backpulver) für speziellere Zwecke sind im gut sortierten Lebensmitteleinzelhandel erhältlich.
4.3. Calciumhydroxid
Calciumhydroxid ist gelöschtes Calciumoxid und daher einfacher und ungefährlicher in der Anwendung als Letzteres. Kaufen Sie hiervon lieber kleinere Mengen entsprechend Ihrem ein- bis zweijährigen Bedarf, und verschließen Sie es luftdicht, da Calciumhydroxid das Kohlenstoffdioxid aus der Umgebungsluft bindet und dadurch unbrauchbar wird.
Bei älteren Beständen kann gesättigtes Kalkwasser hergestellt werden, der flüssige Überstand hiervon hat eine definierte, temperaturabhängige Konzentration.
5. Zusammenfassung
- Für die allermeisten Biere ist ein Maische-pH von 5,4 bis 5,6 optimal, wird dieser getroffen, sind andere Wassereigenschaften nachrangig.
- Hellen Bieren kommt geringe oder sogar negative Restalkalität zugute, dunkle Bierstile können von höherer Restalkalität profitieren. Hopfige Biere erfordern meist geringere Restalkalitäten als milde Biere.
- Mehr gelöste Salze sind geschmacklich nur in wenigen Stilen von Vorteil. Daher im Zweifelsfall lieber Unerwünschtes aus dem Wasser herausholen, anstatt noch mehr Salze hinzuzufügen – vor allem bei hohen Stammwürzen.
- Im Zweifelsfall an Säure- und Salzgaben lieber schrittweise herantasten, die Maische ist ein komplexes System und reagiert nicht immer wie gewünscht.
- Die pH-Messung ist für reproduzierbare Ergebnisse daher unerlässlich.
Quellen
- John Palmer, Colin Kaminski: Water. A Comprehensive Guide for Brewers. Brewers Publications, 2013
- Kai Tröster via Brewers Friend: Mash Chemistry and Brewing Water Calculator. http://www.brewersfriend.com/mash-chemistry-and-brewing-water-calculator
- Kai Tröster: Building brewing water with dissolved chalk. http://braukaiser.com/wiki/index.php?title=Building_brewing_water_with_dissolved_chalk
- EZWaterCalculator. http://www.ezwatercalculator.com
- A. J. deLange: Mash pH Prediction Spreadsheet.
http://www.wetnewf.org/pdfs/Brewing_articles/MashpH.xlsx - Ludwig Narziß: Die Bierbrauerei. Band 2. Wiley-VCH, 2010

Hier kann man die Wasseranalysen vom Trinkwasser-Institut empfehlen! Da gibt es Analysen auf unterschiedliche Parameter, je nachdem was man benötigt gibt es komplette Sets oder Einzelparameter.
Pingback: Brauwasser: Grundlagen und Aufbereitung | WurmWeb
Kann es sein, dass sich bei der Beschreibung des Magnesiumchlorid-Hexahydrat ein Fehler eingeschlichen hat?
In der Tabelle steht, dass es pro Gramm 119,53 mg Magnesium und 174,39 mg Chlorid einbringt. Ich bin kein Chemiker, aber ich glaube der Chlorid-Wert müsste doppelt so hoch sein.
MgCl2*6H2O besteht aus 1 Magnesium-Atom, ZWEI Chlor-Atomen, 6 Sauerstoff und 12 Wasserstoff. Addiert man die Molgewichte all dieser Atome, dann kommt man auf etwa 203,303 kg/mol.
1 mol Magnesiumatome wiegt 24,305 kg, das Magnesium stellt also gut 10% des Gewichts, genauer gesagt 1 kg /203,303 kg/mol * 24,305 kg/mol = 0,11955 kg = 119,55 g.
Hurra, genau das steht für Magnesium in der Tabelle. Und es sind auch die grob geschätzten gut 10% des Gewichts.
Nun dasselbe für das Chlorid. Ein MgCl2*6H2O enthält – und da liegt entweder der Fehler in der Tabelle oder mein Laien-Denkfehler – doch eigentlich ZWEI Chlor-Atome. Oder? Ein mol Chlor-Atome wiegt 35,45 kg, ein mol Magnesiumchlorid Hexahydrat enthält aber ZWEI mol Chlor-Atome, also 70,9 kg Chlor. Das ist gut ein Drittel der 203 kg, die ein mol von dem Hexahydrat wiegt. Und schon an dieser Stelle müsste man erwarten, dass 1 Gramm Magnesiumchlorid Hexahydrat gut ein drittel Gramm Chlor enthält, deutlich mehr als die angegebenen 174 mg.
Rechnen wir wieder, dann sollten es sein: 1 kg /203,303 kg/mol * 70,9 kg/mol = 0,3487 kg = 348,7 g
Genau: gut ein drittel Gramm. Und diese Zahl ist genau das doppelte als in der Tabelle angegeben, daher vermute ich es wurde übersehen, dass ZWEI Chlor-Atome drinstecken? Oder ein Denkfehler oder Wissenslücke meinerseits?
Aber beim Natriumchlorid passt meine Rechnung für das Chlorid auch…
Eine einfache Anfrage an die örtliche Wasserversorgung kann schon Wunder wirken: ich habe auf Anfrage kostenlos die Ergebnisse aus der Trinkwasser-Analyse zugesandt bekommen.
Danke für den tollen Artikel!
Ehrlich gesagt finde ich das Thema total unterschätzt. Die Auswirkung einer guten Wasseraufbereitung sind selbst für Laien spürbar und ein riesen Schritt zum besseren Bier.
Der Artikel geht wunderbar auf alle Einzelheiten ein und gibt einen guten Überblick über alle Möglichkeiten.
Leider fragen mich immer noch sehr viele Leute, wie eine gute Aufbereitung funktioniert. Scheinbar muss ich noch mehr Werbung für diesen Artikel machen 🙂
Die Liste für die verschiedenen Bierstile nutze ich übrigens bei jedem Sud! Top recherchiert und zusammengestellt.
VG
Tobi von Malzknecht.de
Pingback: Brauwasser aufbereiten in 5 Schritten! Bier Wasseraufbereitung
Pingback: Brauwasser und Restalkalität in 5 Minuten erklärt!